S 小姐第一次來門診,是和未婚夫一起討論婚前健檢。未婚夫已知自己是威爾森氏症(一種銅代謝障礙的體染色體隱性遺傳疾病)帶因者。除了安排常規婚前健檢外,也諮詢遺傳相關問題。在確認院內愛基因(註一)檢測項目包含威爾森氏症篩檢後,便安排雙方進行愛基因檢查。一個月後答案揭曉——在愛基因檢測的範圍內雙方未有相同帶因,S 小姐本身也沒有性聯遺傳隱性帶因的情況,不需要為了遺傳疾病而進行試管療程。然而,意外發現S小姐雖然年輕,但抗穆勒氏管荷爾(AMH) 卻僅剩 0.7ng/ml。由於雙方因生涯規劃關係,隔年才有結婚生育的計畫,討論後,便決定開始凍卵計畫。

進入療程時,超音波確認初始卵泡共有7顆,表現優於 AMH 所預期,因此使用口服藥加針劑進行卵巢刺激,最終取得15顆卵子。但因破卵針效果發揮不佳,成熟卵子僅5顆,因 S 小姐年輕(約 6~10 顆卵子便有活產機會),加上預計生育時間是隔年,於是討論隔年結婚後再安排一次取卵並直接受精。第二次進行卵巢刺激時,依據第一次經驗調整破卵針時間後,總共獲得8顆卵子,並有6顆成熟。受精後獲得3顆胚胎,依照 S 小姐的年紀,建議植入一顆,但夫妻雙方討論後,決定植入兩顆胚胎,後續懷了異卵雙胞胎,順利畢業。
近年來,除了凍卵的需求逐年上升,孕前遺傳疾病基因篩檢的需求其實也悄然上升。除了許多婚前或孕前的夫妻,不少已知家族病史的凍卵女性也會關心自身其他隱性遺傳疾病帶因的情況。以送子鳥為例,2023 年接受愛基因檢查的人數為 466 人,2024 年則為 615 人。早期帶因篩檢應用於高危險族群,例如有家族遺傳疾病史或該族群帶因機率極高,且施行對象通常是懷孕婦女。若確認孕婦帶因後,會進一步確認另一半是否也同樣帶因;若雙方皆為帶因者的情況下,則以羊膜穿刺診斷子代是否發病。然而隨著基因解密以及基因診斷工具的進步,基因檢測的範圍不斷擴大、成本亦逐漸降低。因此,擴展性帶因者篩檢(Expanded carrier screening, ECS)已日漸應用於臨床除了同時偵測多項體染色體隱性基因與性聯遺傳隱性基因,施行對象也從高危險族群孕婦,逐步延伸至非高危險族群及孕前階段。

在生殖領域,ECS 目前也應用在進行試管嬰兒的不孕夫妻。根據 2023 年發表的一篇美國涵蓋 9018 試管週期的多中心臨床試驗分析,約有 15% 的不孕夫妻在進行試管前選擇進行 ECS 來協助後續臨床決定。在送子鳥,ECS 也應用於進行試管療程的夫妻、接受捐卵或捐精的族群。若檢測出來子代有發病機率,前者在試管前,可考慮進行植入前胚胎遺傳診斷(Preimplanation genetic test for monogenic disease, PGT-M)來汰除會發病的胚胎,或轉向選擇接受捐贈卵子或精蟲;後者則是在精子庫與卵子庫的支持下,可透過更換捐贈者避免子代發病疑慮。不可否認,ECS 雖然能降低子代罹病風險,但也有其倫理爭議——例如增加試管療程的負擔,及當疾病嚴重程度及基因變異與性狀表現有不確定性時該如何進行後續安排等。
雖然臨床上不少女性因為已知家族病史而選擇凍卵,然而 ECS 在凍卵族群的應用卻鮮少被著墨。即使有應用,大多時機點也是在準備解凍進行試管時,這無疑是在強調凍卵保障生育自主的同時,對於子代罹病風險缺乏了解,少了一份提早準備的選擇權,不免有些令人遺憾。其中主要的原因還是在於:對於未知的另一半,即使進行 ECS,也不知道得知結果後下一步如何進行。但關於這個問題,並非完全沒有方向可思考,以下提出個人見解。
凍卵族群若進行 ECS 後,對於其帶因結果會衍生兩個問題:第一,帶因疾病是否需做後續預防措施?第二,在凍卵策略上該如何改變?
問題的答案,可以從以下三項條件思考:帶因疾病嚴重程度,族群帶因率(carrier frequency),以及遺傳模式(圖一)。

在臨床上,基因遺傳疾病是否需要進行 PGT-M 的關鍵在於疾病嚴重程度。一般來說,早發性、不可治癒及嚴重影響生活品質,甚或致死的疾病是最需要仰賴 PGT-M 進行預防的。然而,相對於試管夫妻已經確定另一半是否帶因,凍卵族群有許多並未有特定對象。此時,可以參考族群帶因率及其遺傳模式去推算子代罹病風險,以決定是否進行預防。
以甲型地中海型為例:在台灣帶因率約為 5%,若凍卵族群經由檢測已知帶因,其子代罹病風險則為 1.25%(註二)。關於其他疾病的子代罹病風險,送子鳥官網亦提供風險計算機可協助推算子代罹病風險。然而,目前對於多少子代罹病風險需要考慮預防措施,並未有共識。不過,個人認為可以以風險高於1%為參考值較強烈建議進行預防,簡單整理如(表一)。
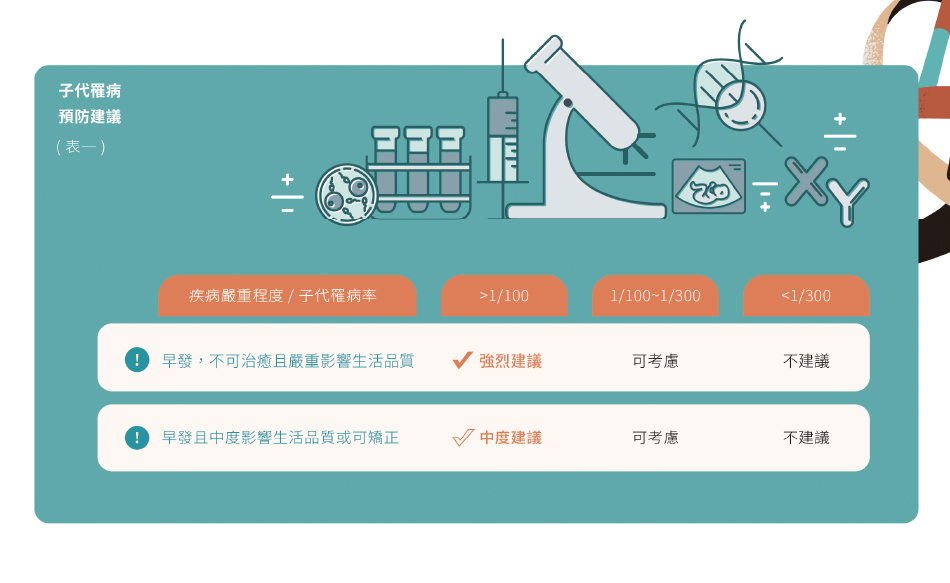
下一個問題是如何調整凍卵的建議。以日常臨床經驗上,PGT-M 族群若為了避免單項體染色體隱性遺傳疾病(臨床較常見,且雙方帶因子代罹病率 25%),需要多準備胚胎。以凍卵族群最常見的 35 歲前為例,根據送子鳥 2020~2022 年統計,此族群的正常染色體胚胎與低鑲嵌胚胎約占總胚胎數的 65% 。下表列舉至少一顆可植入胚胎在不同胚胎數量時的發生率(表二)換言之,PGT-M 的族群需多準備 1.33 倍胚胎,結合送子鳥各年齡建議凍卵數,列舉建議顆數調整(表三)

而在高齡及卵量過低的族群,若評估凍卵產生的效益太低,則建議考慮未來轉向接受捐贈的方向前進。
時代進步快速,近年除了凍卵趨勢增加,不少婚前或凍卵族群也開始關心未來子代的健康。凍卵合併 ECS 的應用,雖然目前仍未有共識,但已是不可忽略的隱性需求。隨著近年 ECS 普及,未來會有更多貼近台灣本土的資料可供醫師參考,進而為客戶提供更精確的建議,不僅滿足凍卵族群的需求,也降低隱形資源浪費的風險。
註一:愛基因為一種擴展性帶因者篩檢(Expanded carrier screening, ECS),同時篩檢350種遺傳疾病基因
註二:子代罹病風險地中海型為體染色體隱性遺傳,參考圖一若雙方皆帶因,寶寶患病機率 25%,已知自身帶因情況,子代罹病風險可推算:0.05(伴侶是帶因者的機率)× 0.25(子代罹病機率)= 0.0125 = 1.25%



